پیوند شیمیایی چیست؟
پیوند شیمیایی نیرویی است که اتمها را در مولکول کنار هم نگه میدارد. پیوند شیمیایی توسط نیروی جاذبه الکترواستاتیکی بین بارهای مخالف، یا بین الکترونها و هستهها، یا در نتیجه جاذبه دوقطبی ایجاد میشود. همه پیوندها را میتوان با تئوری کوانتومی توضیح داد، اما در عمل، قوانین سادهسازی به شیمیدانان اجازه میدهد استحکام، جهت و قطبیت پیوندها را پیشبینی کنند. قانون هشتتایی (octet) و نظریهٔ دافعهٔ جفت الکترون لایه ظرفیت (VSEPR) دو مثال از این قوانین هستند. نظریههای پیچیدهتر، نظریه پیوند ظرفیتی است که شامل هیبریداسیون اوربیتالها و رزونانس، و ترکیب خطی اوربیتالهای اتمی و تشکیل اوربیتالهای مولکولی است.
 پیوند شیمیایی یکی از اساسی ترین مباحث شیمی است که مفاهیم دیگری مانند مولکولها و واکنشهای شیمیایی را توضیح میدهد. بدون در نظر گرفتن این مبحث، دانشمندان نمیتوانند توضیح دهند که چرا اتمها جذب یکدیگر میشوند یا چگونه پس از انجام یک واکنش شیمیایی محصولات تشکیل میشوند. برای درک مفهوم پیوند، ابتدا باید اصول ساختار اتمی را بدانیم.
پیوند شیمیایی یکی از اساسی ترین مباحث شیمی است که مفاهیم دیگری مانند مولکولها و واکنشهای شیمیایی را توضیح میدهد. بدون در نظر گرفتن این مبحث، دانشمندان نمیتوانند توضیح دهند که چرا اتمها جذب یکدیگر میشوند یا چگونه پس از انجام یک واکنش شیمیایی محصولات تشکیل میشوند. برای درک مفهوم پیوند، ابتدا باید اصول ساختار اتمی را بدانیم.
ساختار اتم و پیوند شیمیایی
یک اتم حاوی هستهای متشکل از پروتونها و نوترونها است و الکترونهایی که در ترازهای انرژی مشخص به دور هسته میچرخند. برای بررسی پیوندهای شیمیایی تمرکز اصلی بر روی این الکترونها خواهد بود. عناصر بهواسطه “ابر الکترونی” یا ناحیهای از اتم که الکترونها در اطراف هسته اتم حرکت میکنند از یکدیگر قابل تشخیص هستند. هر عنصر دارای یک ابر الکترونی متمایز است، این ویژگی خواص شیمیایی و همچنین میزان واکنشپذیری آنها را تعیین میکند. به عنوان مثال گازهای نجیب بیاثر یا غیرفعال هستند در حالی که فلزات قلیایی بسیار واکنشپذیرند. در پیوندهای شیمیایی، فقط الکترونهای ظرفیت یعنی الکترونهایی که در اوربیتالهای بیرونیترین تراز انرژی (لایه ظرفیت) یک عنصر قرار دارند، دخالت دارند.
انواع پیوند شیمیایی
پیوند یونی
در پیوند یونی الکترونها بین دو اتم به اشتراک گذاشته نمیشوند بلکه انتقال الکترون از یک اتم به اتم دیگر انجام میشود. پیوند یونی بین اتم نافلز و اتم فلز تشکیل میشود.

یون سدیم (+Na) و یون کلر (–Cl) از طریق پیوند یونی با هم ترکیب میشوند. +Na به دلیل شعاع اتمی زیاد الکترونگاتیوی کمتری دارد و اساساً الکترونی را که در لایه ظرفیت دارد نمیخواهد و به راحتی به اتم کلر الکترونگاتیوتر اجازه میدهد تا این الکترون را برای تکمیل تراز انرژی سوم خود به دستآورد. در طول این فرآیند، انرژی آزاد میشود.
پیوند کووالانسی
پیوندهای کووالانسی زمانی تشکیل میشوند که الکترونها بین اتمها به اشتراک گذاشته شده و توسط هستههای هر دو اتم جذب میشوند. پیوند کووالانسی معمولاً بین نافلز و نافلز تشکیل میشود. به توانایی یک اتم برای جذب یک جفت الکترون به سمت خود در یک پیوند شیمیایی را الکترونگاتیوی آن اتم میگویند.
از آنجایی که الکترونگاتیوی اتمهای نافلزی همه در محدوده بالایی قرار دارد، الکترونها توسط هر دو هسته اتم جذب میشوند. در مورد دو اتم یکسان که به یکدیگر پیوند خوردهاند (این نوع پیوند همچنین به عنوان پیوند غیرقطبی شناخته میشود، که در ادامه توضیح داده میشود)، هر دو نیروی جاذبه یکسانی را بر روی الکترونها اعمال میکنند، بنابراین جاذبه یکسانی بین دو اتم وجود دارد (مثل مولکول اکسیژن). این مسئله شکستن پیوندهای کووالانسی را سختتر میکند.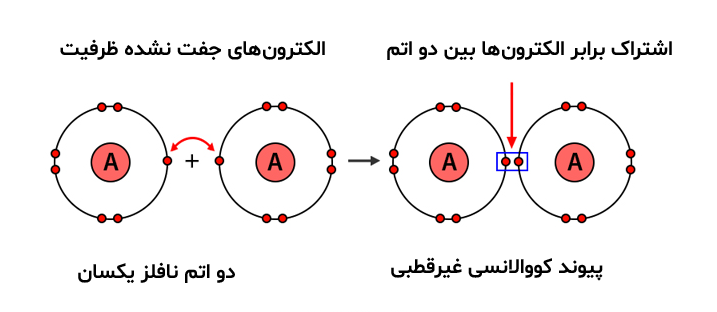
سه نوع پیوند کووالانسی وجود دارد: پیوندهای ساده، دوگانه و سه گانه. یک پیوند ساده از 2 الکترون پیوندی تشکیل شده است. به همین ترتیب، پیوند دوگانه دارای 4 الکترون و یک پیوند سه گانه دارای 6 الکترون است. هر چه پیوند بیشتر یا استحکام پیوند بیشتر باشد، طول پیوند کوتاهتر خواهد بود. به عبارت دیگر:
طول پیوند: پیوند سه گانه < پیوند دوگانه < پیوند ساده
قدرت پیوند: پیوند سه گانه > پیوند دوگانه > پیوند ساده
پیوند کووالانسی قطبی
پیوند کووالانسی قطبی فرآیند به اشتراک گذاری نابرابر الکترونها است. این پیوند نقطه میانی بین پیوند یونی و پیوند کووالانسی در نظر گرفته میشود. پیوند کووالانسی قطبی، به دلیل مقادیر متفاوت الکترونگاتیوی دو اتم اتفاق میافتد. اتم الکترونگاتیو بیشتر الکترونها را به سمت خود جذب کرده و نیروی جاذبه قویتری روی الکترونها خواهد داشت. بنابراین، الکترونها زمان بیشتری را در اطراف این اتم میگذرانند.
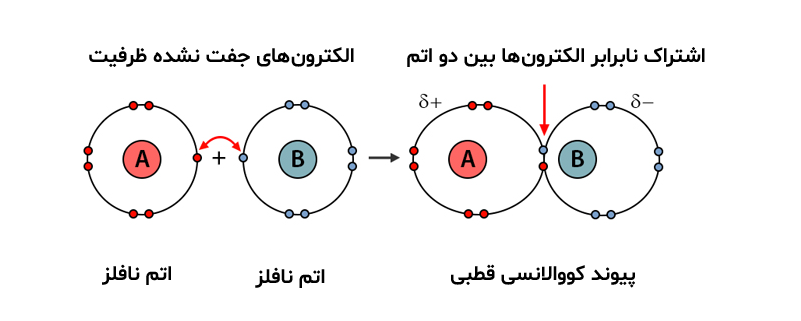
مولکولهای قطبی و غیرقطبی
قطبیت نیروی رقابتی بین دو اتم برای جذب الکترون است. یک مولکول زمانی قطبی است که الکترونها به دلیل میل الکترونی بیشتر به اتم الکترونگاتیوتری جذب شوند. یک مولکول غیرقطبی پیوندی بین دو اتم یکسان است. چنین پیوندهایی نمونه ایدهآل پیوند کووالانسی هستند. گاز نیتروژن (N2)، گاز اکسیژن (O2) و گاز هیدروژن (H2) مثالهایی از مولکولهای غیرقطبی هستند.
یکی از راههای تشخیص نوع پیوند یک مولکول، تعیین تفاوت مقادیر الکترونگاتیوی اتمها است.
اگر اختلاف بین 0.0-0.3 باشد، مولکول دارای پیوند غیرقطبی است.
اگر اختلاف بین 0.3-1.7باشد، مولکول دارای پیوند قطبی است.
اگر اختلاف 1.7 یا بیشتر باشد، مولکول دارای پیوند یونی است.
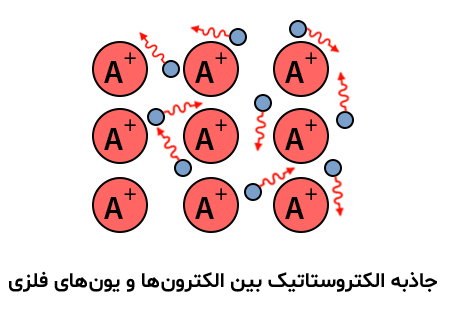
پیوند فلزی
سومین نوع اصلی پیوند شیمیایی، پیوند فلزی است. در حالی که پیوندهای یونی فلزات را به نافلزات و پیوندهای کووالانسی نافلزات را به یکدیگر میپیوندند، پیوند فلزی اتمهای فلزی را به یکدیگر میپیوندد. یک ماده فلزی ممکن است یک عنصر خالص باشد (مانند فویل آلومینیوم، سیمهای مس)، یا ممکن است مخلوطی از دو یا چند عنصر در یک آلیاژ باشد (مانند برنج، جواهرات “طلای سفید”).
فلزات معمولاً دارای نقطه ذوب و نقطه جوش بالایی هستند که نشان دهنده پیوندهای قوی بین اتمها است. حتی یک فلز نرم مانند سدیم (نقطه ذوب 97.8 درجه سانتیگراد) در دمای بسیار بالاتری نسبت به عنصر (نئون) که قبل از آن در جدول تناوبی قرار دارد ذوب میشود. با این حال، بر خلاف ترکیبات یونی، فلزات معمولاً چکشخوار هستند تا شکننده، که نشان میدهد آنها ساختار شبکهای سفت و سختی از یونهای دارای بار مخالف را تشکیل نمیدهند. در دهه 1900، پل درود با مدلسازی فلزات به عنوان مخلوطی از هستههای اتمی (هستههای اتمی = هستههای مثبت + پوسته داخلی الکترونها) و الکترونهای ظرفیت، نظریه پیوند فلزی “دریای الکترون” را ارائه کرد.
جمعبندی:
پیوند شیمیایی نیروی جاذبه بین اتمها است که امکان تشکیل ترکیبات شیمیایی حاوی دو یا چند اتم را فراهم میکند. الکترونهای ظرفیت (خارجیترین) اتمها در پیوندهای شیمیایی شرکت میکنند. پیوند کووالانسی از به اشتراک گذاشته شدن الکترون بین دو اتم تشکیل میشود. در پیوندهای کووالانسی خالص، الکترونها به طور مساوی بین دو اتم تقسیم میشوند ولی در پیوندهای کووالانسی قطبی، الکترونها به طور نابرابر تقسیم میشوند، زیرا یک اتم نسبت به اتم دیگر نیروی جاذبه قویتری بر روی الکترونها اعمال میکند. تفاوت در الکترونگاتیوی بین دو اتم تعیین میکند که یک پیوند چقدر قطبی خواهد بود.
در یک مولکول دو اتمی با دو اتم یکسان، هیچ تفاوتی در الکترونگاتیوی وجود ندارد، بنابراین پیوند غیرقطبی یا کووالانسی خالص است. هنگامی که اختلاف الکترونگاتیوی بسیار زیاد است، مانند موردی که بین فلزات و نافلزات وجود دارد، پیوند یونی تشکیل میشود. در پیوند یونی الکترون از اتم فلزی به اتم نافلز منتقل میگردد. پیوند بین اتمهای فلزی از نوع پیوند فلزی است.
لطفاً نظر ارزشمند خود را درباره این مقاله بنویسید.



