ماده، سنگ بنای جهان هستی
به اطراف خود نگاه کنید؛ کتابی که در دست دارید، هوایی که تنفس میکنید، آبی که مینوشید و حتی ستارههای درخشان آسمان شب، همگی از یک مفهوم بنیادی تشکیل شدهاند: ماده. درک “ماده و حالات آن” نه تنها اولین قدم برای ورود به دنیای جذاب شیمی است، بلکه کلیدی برای فهم پدیدههای روزمرهای است که هر لحظه با آنها سروکار داریم.
این مقاله یک راهنمای جامع و کامل برای شماست تا به زبانی ساده و روان، با تعریف ماده، حالات مختلف آن، فرآیندهای شگفتانگیز تبدیل این حالات به یکدیگر و در نهایت، روشهای طبقهبندی مواد آشنا شوید. اگر به دنبال درک عمیق مفاهیمی مانند ذوب، انجماد، تبخیر و تصعید هستید، این سفر علمی را از دست ندهید.
ماده چیست؟ (تعریف دقیق و علمی)
در علم شیمی و فیزیک، ماده (Matter) به هر چیزی گفته میشود که جرم (Mass) داشته باشد و فضا را اشغال کند (حجم داشته باشد). این تعریف ساده، تمام جهان فیزیکی ما را در بر میگیرد. از کوچکترین ذره زیراتمی تا بزرگترین کهکشانها، همگی مصداق ماده هستند. سنگ بنای تشکیلدهنده تمام مواد، اتمها و مولکولها هستند. رفتار این ذرات میکروسکوپی و میزان انرژی آنهاست که تعیین میکند ماده در چه حالتی ظاهر شود.
حالات ماده: چهرههای گوناگون یک وجود
ماده معمولاً در چهار حالت اصلی یافت میشود. تفاوت اصلی این حالات در نحوه آرایش ذرات (اتمها و مولکولها) و میزان انرژی جنبشی آنهاست.
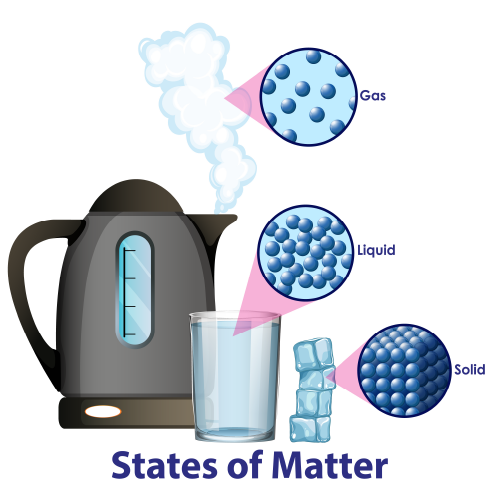
حالت جامد (Solid)
در حالت جامد، ذرات تشکیلدهنده ماده به شدت به یکدیگر نزدیک هستند و در مکانهای ثابتی نوسان میکنند. نیروهای بین مولکولی در جامدات بسیار قوی است. به همین دلیل، جامدات شکل و حجم معینی دارند.
- ویژگیها: شکل ثابت، حجم ثابت، تراکم بالا.
- مثال: یخ، سنگ، فلزات، چوب.
حالت مایع (Liquid)
اگر به یک جامد به اندازه کافی گرما بدهیم، انرژی ذرات آن افزایش یافته و میتوانند از مکان ثابت خود خارج شده و روی یکدیگر سُر بخورند. در این حالت، ماده به مایع تبدیل میشود. مایعات حجم معین دارند اما شکل ثابتی ندارند و به شکل ظرف خود درمیآیند.
- ویژگیها: شکل نامعین، حجم معین، تراکم کمتر از جامدات (معمولاً).
- مثال: آب، روغن، الکل، جیوه.
حالت گاز (Gas)
با افزایش بیشتر انرژی، ذرات مایع آنقدر سریع حرکت میکنند که میتوانند بر نیروهای جاذبه بین مولکولی غلبه کرده و آزادانه در تمام فضای موجود پخش شوند. گازها نه شکل معین و نه حجم معینی دارند و به راحتی متراکم میشوند.
- ویژگیها: شکل نامعین، حجم نامعین، تراکم بسیار پایین.
- مثال: بخار آب، اکسیژن، کربن دی اکسید .
حالت پلاسما (Plasma)
پلاسما که اغلب “حالت چهارم ماده” نامیده میشود، حالتی شبیه به گاز است اما با یک تفاوت اساسی: انرژی ذرات آنقدر زیاد است که الکترونها از اتمها جدا شده و یونهای مثبت و الکترونهای آزاد را به وجود میآورند. این ترکیب از ذرات باردار، پلاسما را از نظر الکتریکی رسانا میکند.
- ویژگیها: شبیه به گاز اما رسانای الکتریسیته و واکنشپذیر به میدانهای مغناطیسی.
- مثال: خورشید و سایر ستارگان، صاعقه، شعله آتش.
تبدیل حالات ماده به یکدیگر: رقصی بیپایان از انرژی
ماده ایستا نیست و با گرفتن یا از دست دادن انرژی (معمولاً به شکل گرما) میتواند از یک حالت به حالت دیگر تبدیل شود. این فرآیندها نامهای مشخصی دارند که در ادامه به تفصیل بررسی میکنیم.
ذوب (Melting): از جامد به مایع
وقتی یک جامد گرما جذب میکند، انرژی جنبشی ذرات آن افزایش مییابد. در نقطهای به نام نقطه ذوب، انرژی به حدی میرسد که ذرات میتوانند از ساختار منظم خود خارج شوند و آزادانه حرکت کنند. این فرآیند ذوب نام دارد.
- مثال کلیدی: ذوب شدن یک قطعه یخ و تبدیل آن به آب.

انجماد (Freezing): از مایع به جامد
انجماد دقیقاً عکس فرآیند ذوب است. وقتی از یک مایع گرما گرفته میشود (سرد میشود)، سرعت حرکت ذرات آن کاهش مییابد. در نقطه انجماد، نیروهای بین مولکولی بر انرژی جنبشی غلبه کرده و ذرات را در یک ساختار منظم و ثابت قفل میکنند و مایع به جامد تبدیل میشود.
- مثال کلیدی: قرار دادن آب در فریزر و تبدیل آن به یخ.
تبخیر (Evaporation): از مایع به گاز
تبخیر فرآیندی است که طی آن یک مایع به گاز تبدیل میشود. این فرآیند میتواند در هر دمایی رخ دهد (مانند خشک شدن لباس خیس در هوای آزاد) اما با افزایش دما، سرعت آن به شدت زیاد میشود. وقتی تبخیر در کل توده مایع و در دمای مشخصی (نقطه جوش) رخ دهد، به آن جوشیدن (Boiling) میگویند.
- مثال کلیدی: بخار شدن آب کتری هنگام جوش آمدن یا خشک شدن یک گودال آب پس از باران.
میعان یا چگالش (Condensation): از گاز به مایع
میعان که به آن چگالش یا در برخی متون تبرید (به معنی سردسازی منجر به تغییر فاز) نیز میگویند، عکس عمل تبخیر است. وقتی یک گاز سرد میشود، ذرات آن انرژی از دست داده و سرعتشان کم میشود. این کاهش سرعت به نیروهای جاذبه بین مولکولی اجازه میدهد تا دوباره ذرات را کنار هم جمع کرده و حالت مایع را تشکیل دهند.
- مثال کلیدی: تشکیل قطرات آب روی جداره بیرونی یک لیوان نوشیدنی سرد یا تشکیل شبنم صبحگاهی روی برگ گیاهان.
تصعید یا فرازش (Sublimation): جهشی از جامد به گاز
شاید جالب باشد بدانید که برخی مواد میتوانند مستقیماً از حالت جامد به گاز تبدیل شوند، بدون آنکه وارد فاز مایع شوند. این فرآیند شگفتانگیز تصعید نام دارد. در فارسی به آن فرازش نیز میگویند.
- مثال کلیدی: “یخ خشک” (کربن دی اکسید جامد) که در دمای اتاق مستقیماً به گاز دیاکسید کربن تبدیل میشود و دودی سفید و غلیظ ایجاد میکند. قرص نفتالین نیز با گذشت زمان از طریق تصعید کوچک میشود.

تبرید یا چگالش (Deposition): از گاز به جامد
فرآیند معکوس تصعید، چگالش نام دارد که طی آن یک ماده مستقیماً از حالت گاز به جامد تبدیل میشود.
- مثال کلیدی: تشکیل برفک در داخل فریزرهای قدیمی. بخار آب موجود در هوا در تماس با سطوح بسیار سرد، مستقیماً به بلورهای یخ (برفک) تبدیل میشود.

طبقهبندی مواد: نگاهی دقیقتر به ساختار
شیمیدانها برای مطالعه بهتر، مواد را بر اساس ترکیب و خواصشان به دو گروه اصلی طبقهبندی میکنند: مواد خالص و مخلوطها.
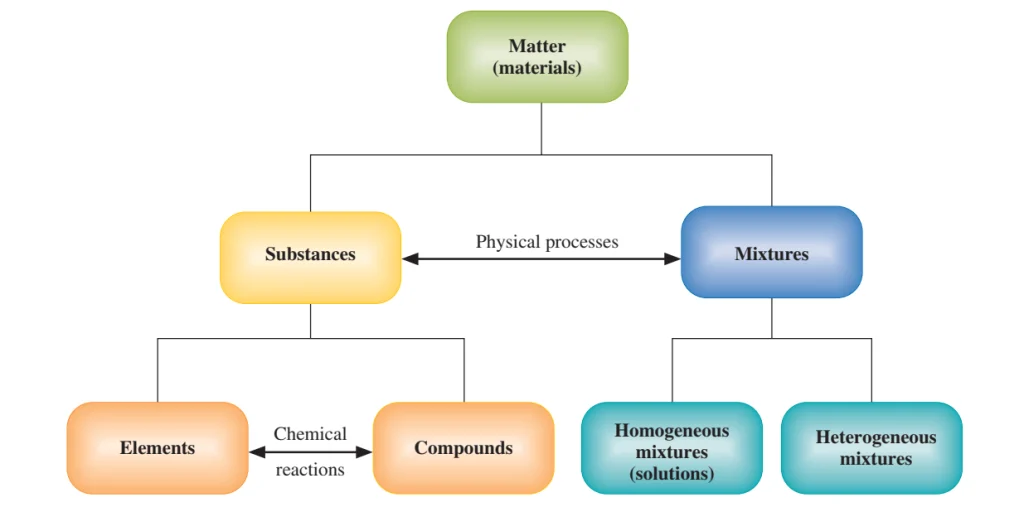
مواد خالص (Pure Substances)
ماده خالص نوعی از ماده است که ترکیب شیمیایی ثابت و مشخصی دارد و نمیتوان آن را با روشهای فیزیکی به اجزای سادهتر تفکیک کرد:
عناصر (Elements): سادهترین شکل ماده خالص هستند که تنها از یک نوع اتم تشکیل شدهاند. عناصر را نمیتوان با واکنشهای شیمیایی به مواد سادهتر تجزیه کرد. مثال: اکسیژن (O)، آهن (Fe)، طلا (Au).

ترکیبات (Compounds): از پیوند شیمیایی دو یا چند عنصر مختلف با نسبتهای جرمی ثابت به وجود میآیند. خواص یک ترکیب کاملاً متفاوت از خواص عناصر سازنده آن است. مثال: آب (H₂O) که از پیوند هیدروژن و اکسیژن تشکیل شده است.

مخلوطها (Mixtures)
مخلوط از ترکیب فیزیکی دو یا چند ماده خالص (عنصر یا ترکیب) تشکیل شده است، به طوری که هر ماده هویت شیمیایی خود را حفظ میکند. اجزای یک مخلوط را میتوان با روشهای فیزیکی (مانند فیلتر کردن یا تبخیر) از هم جدا کرد.
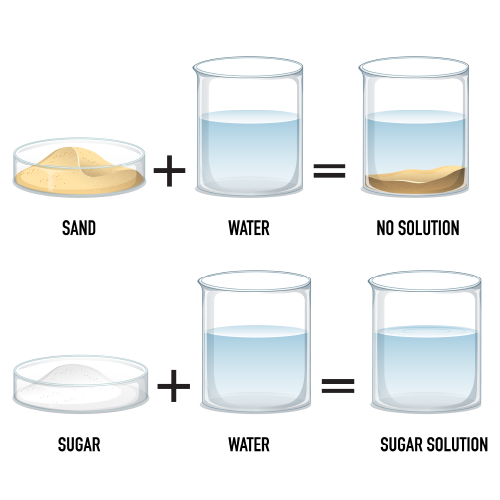
مخلوط همگن (Homogeneous Mixture): مخلوطی است که اجزای آن به طور یکنواخت در سراسر آن پخش شدهاند و ظاهر یکسانی دارد. به این مخلوطها “محلول” نیز میگویند. مثال: آب نمک، هوا، آلیاژهای فلزی.
مخلوط ناهمگن (Heterogeneous Mixture): مخلوطی است که اجزای آن به طور غیریکنواخت پخش شدهاند و میتوان اجزای مختلف آن را با چشم تشخیص داد. مثال: مخلوط آب و روغن، سالاد، خاک.
نتیجهگیری: چرا درک ماده و حالات آن مهم است؟
درک مفهوم ماده و حالات آن و فرآیندهایی مانند ذوب، انجماد، تبخیر، چگالش و تصعید، زیربنای اصلی علم شیمی و بسیاری از علوم دیگر است. این دانش به ما کمک میکند تا پدیدههای جهان اطرافمان را بهتر بشناسیم؛ از چرخه آب در طبیعت گرفته تا فرآیندهای صنعتی پیچیده و پختوپز در آشپزخانه.
هر تغییر حالتی، داستانی از تبادل انرژی و رقص مولکولهاست. با شناخت این مفاهیم، شما نه تنها یک قدم بزرگ در مسیر یادگیری شیمی برداشتهاید، بلکه نگاهی عمیقتر و دقیقتر به جهانی که در آن زندگی میکنید، پیدا کردهاید. امیدواریم این مقاله جامع، چراغ راه شما در این مسیر علمی بوده باشد.



