نیروی پنهان در هر واکنش
وقتی به کلمه “نیرو” فکر میکنیم، شاید تصاویری از کشیدن یک جعبه سنگین، جاذبه زمین که ما را روی سطح نگه میدارد، یا حتی یک موشک که به فضا پرتاب میشود در ذهن ما شکل بگیرد. اینها همگی نمونههای درستی از نیرو در دنیای فیزیک ماکروسکوپی هستند. اما آیا میدانستید که همین مفهوم بنیادین، در قلب دنیای میکروسکوپی شیمی نیز حکمرانی میکند؟
از پیوندی که دو اتم را در یک مولکول کنار هم نگه میدارد تا برهمکنشی که تعیین میکند چرا آب در دمای ۱۰۰ درجه سانتیگراد میجوشد، همگی داستانهایی از نیرو و واحدهای آن هستند.
در این مقاله جامع، ما سفری عمیق به دنیای نیرو خواهیم داشت. ابتدا با تعریف کلاسیک و قوانین حاکم بر آن آشنا میشویم، سپس واحدهای اندازهگیری نیرو را بررسی کرده و در نهایت، پل مفهومی میان این پدیده فیزیکی و کاربردهای حیاتی آن در علم شیمی را بنا خواهیم کرد. اگر به دنبال درک عمیقتر واکنشهای شیمیایی، ساختار مولکولها و رفتار مواد هستید، شناخت نیرو کلید اصلی شماست.
نیرو چیست؟ تعریفی بنیادین
به سادهترین بیان، نیرو یک اثر خارجی است که میتواند حالت سکون یا حرکت یک جسم را تغییر دهد. اگر جسمی در حال سکون است، اعمال نیرو میتواند آن را به حرکت درآورد. اگر جسمی در حال حرکت است، نیرو میتواند سرعت، جهت یا هر دو را تغییر دهد. در واقع، هرگونه “هل دادن” یا “کشیدن” یک نوع اعمال نیرو است.
این مفهوم به بهترین شکل توسط سر آیزاک نیوتن، دانشمند بزرگ انگلیسی، فرمولبندی شد. قوانین حرکت نیوتن، بهویژه قانون دوم او، سنگ بنای درک ما از نیرو است.

قانون دوم نیوتن: سنگ بنای درک نیرو
قانون دوم نیوتن رابطه دقیق بین نیرو، جرم و شتاب را مشخص میکند. این قانون بیان میکند که شتابی که یک جسم میگیرد، نسبت مستقیم با نیروی خالص وارد بر آن و نسبت عکس با جرم آن دارد. فرمول ریاضی این قانون به شکل زیر است:
F=ma
در این فرمول:
- F (Force): نمایانگر نیروی خالص وارد بر جسم است.
- m (Mass): جرم جسم را نشان میدهد که معیاری از مقاومت آن در برابر تغییر حرکت است.
- a (Acceleration): شتاب جسم است، یعنی نرخ تغییرات سرعت آن.
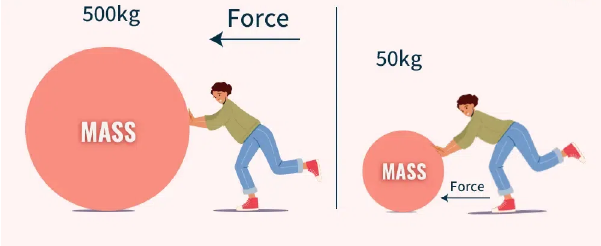
این فرمول ساده اما عمیق، به ما میگوید که برای شتاب دادن به یک جسم سنگین (جرم بالا)، به نیروی بیشتری نیاز داریم تا همان شتاب را در یک جسم سبک (جرم پایین) ایجاد کنیم.
واحدهای اندازهگیری نیرو: زبان مشترک دانشمندان
برای اینکه بتوانیم نیرو را به صورت کمی و دقیق محاسبه کنیم، به واحدهای استاندارد نیاز داریم. در سیستمهای مختلف، واحدهای متفاوتی برای نیرو تعریف شده است که مهمترین آنها عبارتاند از:
سیستم بینالمللی (SI): نیوتن (N)
در دنیای علم و مهندسی، واحد استاندارد و مورد قبول جهانی برای نیرو، نیوتن است که با نماد N نمایش داده میشود. یک نیوتن به این صورت تعریف میشود:
مقدار نیرویی که اگر به جرمی معادل یک کیلوگرم (1kg) وارد شود، به آن شتابی برابر با یک متر بر مجذور ثانیه (1m/s2) میدهد.
بنابراین، بر اساس فرمول (F=ma):
1 N= 1kg⋅m/s2
سیستم CGS: داین (dyn)
در سیستم قدیمیتر CGS (سانتیمتر-گرم-ثانیه)، واحد نیرو داین نام دارد. یک داین مقدار نیرویی است که اگر به جرمی معادل یک گرم (g 1) وارد شود، به آن شتابی برابر با یک سانتیمتر بر مجذور ثانیه (1cm/s2) میدهد.
1 dyn= 1g⋅cm/s2
رابطه بین نیوتن و داین بسیار ساده است:
1 N=100,000 dyn = 105 dyn
جدول تبدیل واحدهای رایج نیرو
برای سهولت در محاسبات، دانستن نحوه تبدیل واحدها ضروری است.
| واحد مبدأ | معادل به نیوتن (N) | معادل به داین (dyn) |
| 1 نیوتن (N) | 1 | 100,000 |
| 1 داین (dyn) | 0.00001 | 1 |
| 1 پوند-نیرو (lbf) | 4.44822 | 444,822 |
| 1 کیلوگرم-نیرو (kgf) | 9.80665 | 980,665 |
انواع نیروهای بنیادی در طبیعت
دانشمندان تمام نیروهای شناختهشده در جهان را به چهار دسته بنیادی تقسیم میکنند. این نیروها منشأ تمام برهمکنشهایی هستند که ما مشاهده میکنیم:
- نیروی گرانش: ضعیفترین اما با برد بینهایت. این نیرو بین تمام اجسامی که جرم دارند وجود دارد و مسئول پدیدههایی مانند مدار سیارات و افتادن سیب از درخت است.
- نیروی الکترومغناطیسی: بسیار قویتر از گرانش. این نیرو بین ذرات باردار عمل میکند و مسئول پدیدههایی مانند الکتریسیته، مغناطیس، نور و تقریباً تمام پدیدههای شیمیایی است.
- نیروی هستهای قوی: قویترین نیروی بنیادی که پروتونها و نوترونها را در هسته اتم در کنار هم نگه میدارد و بر دافعه الکتریکی عظیم بین پروتونها غلبه میکند.
- نیروی هستهای ضعیف: این نیرو مسئول واپاشیهای رادیواکتیو خاصی در هسته اتمهاست.
پل میان فیزیک و شیمی: نیرو در دنیای مولکولها
اینجاست که بحث برای علاقهمندان به شیمی جذابتر میشود. شاید بپرسید کاربرد نیرو در شیمی چیست؟ پاسخ این است: تقریباً همهچیز! نیروی حاکم بر دنیای شیمی، نیروی الکترومغناطیسی است.
نیروهای درون مولکولی (Intramolecular Forces)
این نیروها همان پیوندهای شیمیایی هستند که اتمها را در یک مولکول کنار هم نگه میدارند.
- پیوند کووالانسی: نیروی جاذبه الکترواستاتیکی بین هسته مثبت اتمها و الکترونهای به اشتراک گذاشتهشده بین آنها.
- پیوند یونی: نیروی جاذبه الکترواستاتیکی قوی بین یونهای با بار مخالف (کاتیونها و آنیونها) در یک شبکه بلوری.
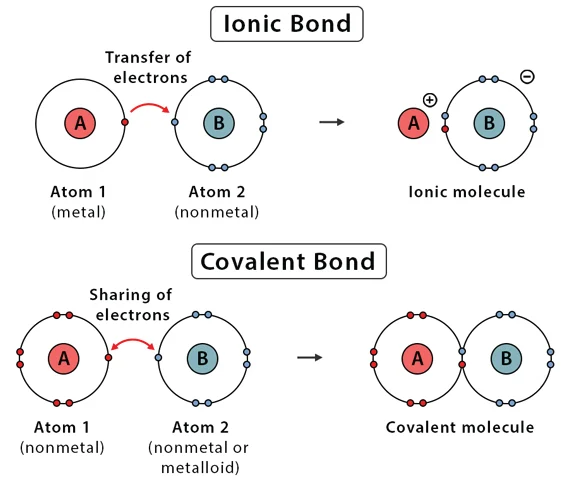
قدرت این نیروها تعیینکننده پایداری یک مولکول است. برای شکستن یک پیوند شیمیایی، باید انرژی کافی برای غلبه بر این نیروی نگهدارنده اعمال کرد.
نیروهای بین مولکولی (Intermolecular Forces)
این نیروها ضعیفتر از پیوندهای شیمیایی هستند اما نقشی حیاتی در تعیین خواص فیزیکی مواد (مانند نقطه جوش، نقطه ذوب، ویسکوزیته و حلالیت) ایفا میکنند.
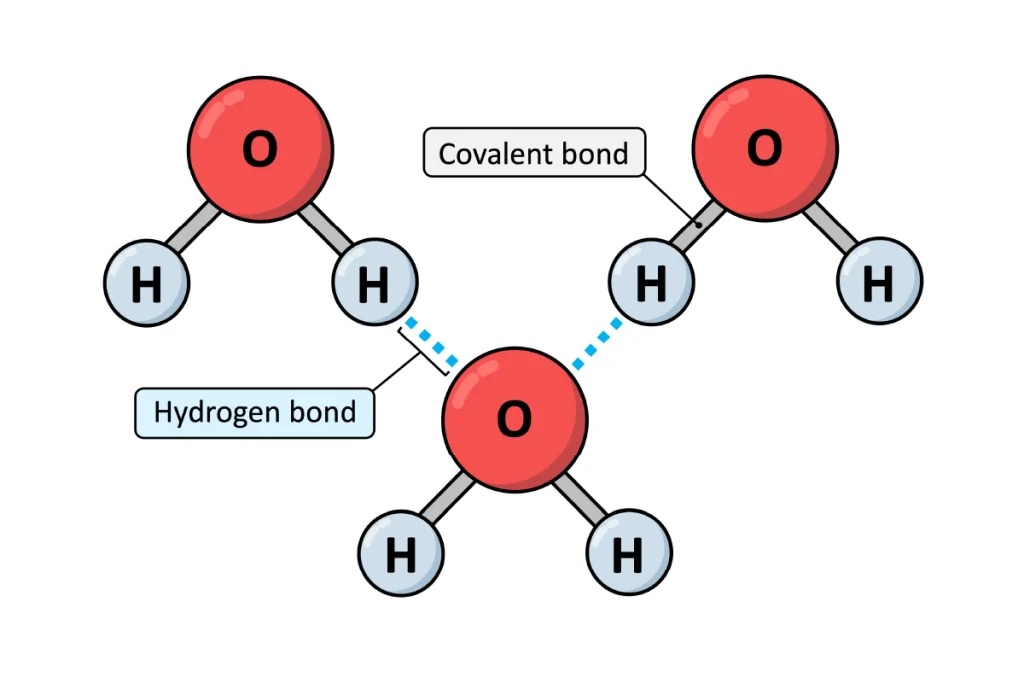
- نیروهای واندروالس (Van der Waals): شامل نیروهای پراکندگی لاندن (London Dispersion Forces) و برهمکنشهای دوقطبی-دوقطبی (Dipole-Dipole) هستند. این نیروها بین تمام مولکولها وجود دارند.
- پیوند هیدروژنی: یک نوع خاص و قوی از برهمکنش دوقطبی-دوقطبی است که بین یک اتم هیدروژن (متصل به یک اتم الکترونگاتیو مانند O، N یا F) و یک اتم الکترونگاتیو دیگر رخ میدهد. این نیرو مسئول خواص منحصربهفرد آب است.
نقطه جوش بالای آب (۱۰۰ درجه سانتیگراد) مستقیماً به دلیل وجود نیروهای پیوند هیدروژنی قوی بین مولکولهای آن است که برای غلبه بر آنها و تبدیل مایع به گاز، به انرژی زیادی نیاز است.
 نیرو و واکنشهای شیمیایی
نیرو و واکنشهای شیمیایی
تئوری برخورد (Collision Theory) در سینتیک شیمیایی بیان میکند که برای انجام یک واکنش، ذرات واکنشدهنده باید:
- با یکدیگر برخورد کنند.
- با انرژی کافی (انرژی فعالسازی) برخورد کنند تا پیوندهای موجود شکسته شوند.
- با جهتگیری فضایی مناسب برخورد کنند.
مفهوم “انرژی کافی” در اینجا ارتباط مستقیمی با نیرو دارد. یک برخورد پرانرژی، برخوردی است که با نیروی کافی برای درهمشکستن ساختار الکترونی مولکولها و ایجاد پیوندهای جدید همراه باشد.
پرسشهای متداول در مورد انواع نیرو
۱. واحد اصلی نیرو در محاسبات علمی چیست؟
واحد اصلی و استاندارد نیرو در سیستم بینالمللی (SI)، نیوتن (N) است که بر اساس کیلوگرم، متر و ثانیه تعریف میشود.
۲. تفاوت بین نیرو و انرژی چیست؟
نیرو یک اثر (هل دادن یا کشیدن) است که میتواند حرکت را تغییر دهد (F=ma). انرژی، توانایی انجام کار است. نیرو علت تغییر حرکت است، در حالی که کار (که نوعی انتقال انرژی است) حاصل اعمال نیرو در یک مسافت معین است (W=F⋅d).
۳. چگونه نیرو را اندازهگیری میکنند؟
نیرو را با دستگاهی به نام نیروسنج (Force Gauge یا Dynamometer) اندازهگیری میکنند. این دستگاهها معمولاً از یک فنر کالیبره شده استفاده میکنند که با اعمال نیرو، کشیده یا فشرده میشود.
۴. چرا درک مفهوم نیرو برای یک شیمیدان مهم است؟
زیرا تمام برهمکنشهای شیمیایی، از پیوندهای کووالانسی و یونی گرفته تا نیروهای بین مولکولی که خواص فیزیکی مواد را تعیین میکنند، اساساً ماهیت الکترومغناطیسی دارند. بدون درک نیرو، نمیتوان رفتار اتمها و مولکولها را به درستی تحلیل کرد.
نتیجهگیری: نیروی همهجا حاضر
از مقیاس کیهانی تا دنیای زیراتمی، نیرو یک مفهوم محوری است. در این مقاله، ما دیدیم که نیرو و واحدهای آن چگونه نه تنها قوانین حرکت اجسام بزرگ را توصیف میکنند، بلکه به عنوان زیربنای علم شیمی نیز عمل میکنند. نیروی الکترومغناطیسی، با ایجاد پیوندهای درون مولکولی و نیروهای بین مولکولی، معماری مواد را طراحی کرده و قوانین حاکم بر واکنشهای شیمیایی را تعیین میکند.
بنابراین، دفعه بعد که یک واکنش شیمیایی را در آزمایشگاه مشاهده میکنید یا خواص یک ماده را بررسی مینمایید، به یاد داشته باشید که در حال تماشای نتیجه رقص پیچیده و قدرتمند نیروها در مقیاس مولکولی هستید. درک عمیق این نیروها، دروازهای به سوی نوآوری در طراحی داروها، مواد جدید و فناوریهای پیشرفته است.



