فشار و واحدهای آن: مفهوم، انواع و کاربردهای آن در شیمی و فیزیک
در دنیای علم، به ویژه در شاخههای شیمی و فیزیک، مفهوم فشار یکی از پایهایترین و مهمترین کمیتهای فیزیکی است که در درک پدیدههای طبیعی، واکنشهای شیمیایی و رفتار مواد نقش کلیدی دارد. از تنظیم شرایط واکنشهای صنعتی گرفته تا تحلیل رفتار گازها در دماهای مختلف، فشار همواره در مرکز توجه دانشمندان و مهندسان قرار دارد. در این مقاله به بررسی تعریف فشار، واحدهای آن، انواع فشار، و کاربردهای آن در شیمی میپردازیم. این مطلب برای دانشآموزان، دانشجویان، معلمان و علاقهمندان به شیمی و فیزیک طراحی شده است.
فشار چیست؟ تعریف ساده و علمی
فشار به معنای نیروی وارد شده بر واحد سطح است. در فرمولبندی فیزیکی، فشار با حرف P نشان داده میشود و به صورت زیر تعریف میشود:
P=F/A
که در آن:
(P): فشار (Pressure)
(F): نیروی عمودی وارد شده بر سطح (برحسب نیوتن)
(A): سطحی که نیرو بر آن وارد میشود (برحسب متر مربع)
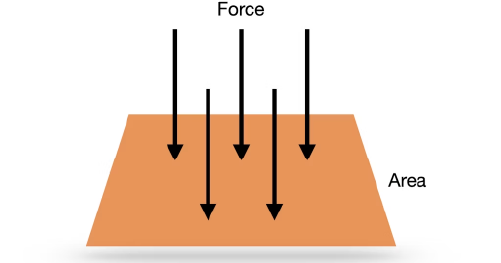
بهعبارت ساده، هرچه نیروی بیشتری بر سطح کوچکتری وارد شود، فشار ایجادشده بیشتر خواهد بود. برای مثال، تیغه تیز چاقو بهراحتی وارد مواد میشود چون نیرو در سطح بسیار کوچکی متمرکز میشود و فشار بالایی ایجاد میکند.
واحدهای فشار: شناخت و تبدیل واحد
در سیستم بینالمللی واحدها (SI)، واحد استاندارد فشار پاسکال (Pa) است. اما در عمل، به دلیل کوچک بودن مقدار پاسکال، از واحدهای دیگری نیز استفاده میشود. در ادامه مهمترین واحدهای فشار را معرفی میکنیم:
پاسکال (Pa)
– واحد استاندارد در SI
1 Pa = 1 N/m2
– برای مثال، فشار اتمسفر در سطح دریا حدود 101325 Pa است.
کیلوپاسکال (kPa)
1 kPa= 1000 Pa
– برای اندازهگیری فشارهای متوسط در آزمایشگاهها و صنایع شیمیایی استفاده میشود.
اتمسفر (atm)
– واحدی مبتنی بر فشار جو در سطح دریا
1 atm = 101325 Pa = 101.325 kPa
واحد اتمسفر بسیار رایج در شیمی گازها و قانونهای گازی است.
میلیمتر جیوه (mmHg) یا تور (Torr)
– از ستون جیوه در بارومتر برای اندازهگیری فشار الهام گرفته شده است.
1 atm = 760 mmHg = 760 Torr
در پزشکی و آزمایشگاههای شیمی کاربرد دارد.
بار (bar) و دسیبار (bar)
1 bar = 100000 Pa = 0.987 atm
– تقریباً برابر با فشار جو، اما دقیقتر نیست.
در اروپا و صنایع مهندسی رایج است.
پوند بر اینچ مربع (psi)
– واحد رایج در آمریکا
1 atm ≈ 14.7 psi
در صنایع خودرو و لاستیک استفاده میشود.

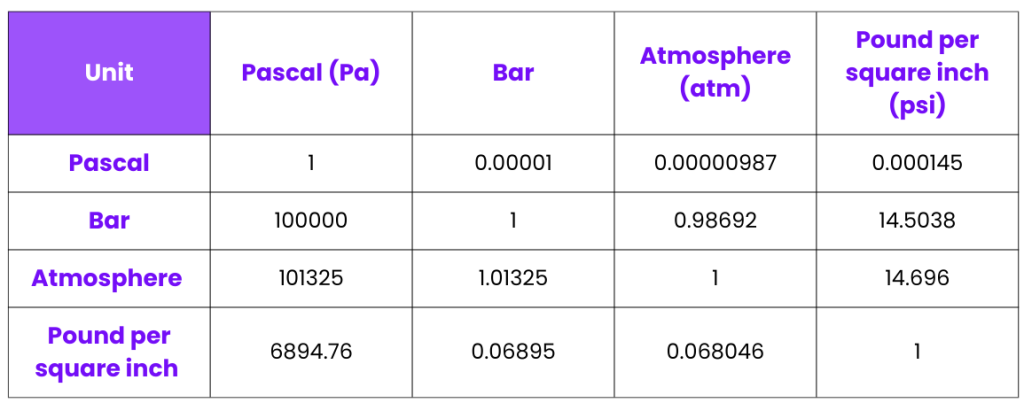
جدول تبدیل واحدهای فشار
این جدول برای تبدیل واحد در محاسبات شیمیایی و حل مسائل بسیار کاربردی است.
انواع فشار در شیمی و فیزیک
در شیمی، فشار به چند شکل مختلف دستهبندی میشود که هر کدام کاربرد خاص خود را دارند:
- فشار اتمسفر (Atmospheric Pressure)
فشاری که لایههای جو بر سطح زمین وارد میکنند. این فشار به ارتفاع از سطح دریا بستگی دارد و با افزایش ارتفاع کاهش مییابد. در سطح دریا، این فشار برابر با atm 1 یا mmHg 760 است.
- فشار سنجشی (Gauge Pressure)
این نوع فشار نسبت به فشار اتمسفر اندازهگیری میشود. برای مثال، اگر فشار داخل یک تایر psi 32 باشد، این عدد نسبت به فشار جو است. فشار مطلق این تایر برابر است با:
P (مطلق ) = P (سنجشی) + P (اتمسفر)
- فشار مطلق (Absolute Pressure)
فشار واقعی یک سیستم که از نقطه صفر مطلق شروع میشود (خلأ کامل). در قوانین گازی مانند قانون بویل و قانون گاز ایدهآل، باید از فشار مطلق استفاده کرد.
- فشار بخار (Vapor Pressure)
حداکثر فشاری که بخار یک مایع در تعادل با مایع خود در دمای مشخص ایجاد میکند. این فشار به دما بستگی دارد و با افزایش دما افزایش مییابد. وقتی فشار بخار مایع برابر با فشار اتمسفر شود، مایع جوش میآید.
کاربرد فشار در شیمی
فشار در بسیاری از مباحث شیمی، به ویژه شیمی فیزیک و شیمی تجزیه، نقش حیاتی دارد. در ادامه به مهمترین کاربردها اشاره میکنیم:
- قوانین گازها
– قانون بویل: در دمای ثابت، فشار گاز با حجم آن رابطه معکوس دارد.
P1 V1 = P2 V2
– قانون چارلز: در فشار ثابت، حجم گاز با دما رابطه مستقیم دارد.
– قانون گیلوساک: در حجم ثابت، فشار گاز با دما رابطه مستقیم دارد.
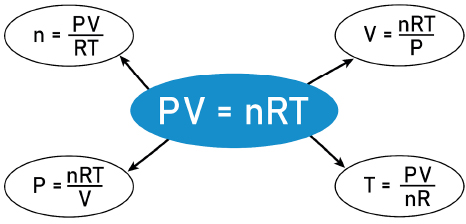
– قانون گاز ایدهآل:
PV = nRT
که در آن (P) فشار مطلق، (V) حجم، (n) تعداد مول، (R) ثابت گاز و (T) دمای مطلق است.
- واکنشهای شیمیایی تحت فشار
در صنایع شیمیایی، بسیاری از واکنشها تحت فشار بالا انجام میشوند. برای مثال:
فرآیند هابر-بوش: تولید آمونیاک از نیتروژن و هیدروژن
این واکنش با کاهش حجم همراه است، بنابراین افزایش فشار به سمت تشکیل محصول (آمونیاک) جابهجا میشود (اصل لوشاتلیه).

- تعادل شیمیایی و فشار
بر اساس اصل لوشاتلیه، اگر در یک سیستم در حال تعادل، فشار افزایش یابد، سیستم به سمتی حرکت میکند که فشار کاهش یابد. یعنی به سمت واکنشی که تعداد مول گاز کمتری تولید میکند.
- آزمایشهای آزمایشگاهی
در آزمایشگاههای شیمی، از دستگاههایی مانند بارومتر (برای اندازهگیری فشار جو)، مانومتر (برای اندازهگیری فشار گاز در مخزن) و پمپ خلاء (برای کاهش فشار) استفاده میشود.
اهمیت فشار در صنعت و زندگی روزمره
– تولید کود شیمیایی: فرآیند هابر-بوش نیاز به فشار 150 تا 300 اتمسفر دارد.
– تصفیه آب به روش اسمز معکوس: از فشار بالا برای عبور آب از غشای نیمهتراوا استفاده میشود.
– پخت غذا در دیگ بخار (کتری فشار): افزایش فشار باعث افزایش نقطه جوش آب و پخت سریعتر غذا میشود.
– پزشکی: فشار خون یکی از شاخصهای مهم سلامتی است که با واحد mmHg اندازهگیری میشود.
نکات مهم برای محاسبات فشار در شیمی
- همیشه از فشار مطلق استفاده کنید، نه فشار سنجشی، بهویژه در قوانین گازی.
- واحدها را قبل از محاسبه استاندارد کنید (ترجیحاً به atm یا kPa).
- در تعادل شیمیایی، فقط گازها تحت تأثیر فشار قرار میگیرند. مواد جامد و مایع تأثیر چندانی ندارند.
- دمای مطلق (کلوین) را فراموش نکنید، چون در فرمولهای گازی ضروری است.
سوالات متداول در مورد فشار
چرا در قانون گاز ایدهآل باید از فشار مطلق استفاده کرد؟
چون این قانون از مدلی نظری شروع میشود که در آن فشار از صفر (خلأ کامل) شروع میشود. استفاده از فشار نسبی باعث اشتباه در محاسبات میشود.
تفاوت mmHg و Torr چیست؟
هر دو تقریباً برابر هستند ولی تور واحد دقیقتری است و برای احترام به توریچلی، مخترع بارومتر، نامگذاری شده است.
فشار اتمسفر در ارتفاعات چگونه تغییر میکند؟
با افزایش ارتفاع، تراکم هوا کاهش مییابد و فشار اتمسفر کم میشود. برای مثال، در قله اورست فشار حدود یک سوم سطح دریا است.
آیا فشار بر نقطه انجماد تأثیر میگذارد؟
بله، اما تأثیر آن نسبت به نقطه جوش کمتر است. برای آب، افزایش فشار کمی نقطه انجماد را کاهش میدهد.
جمعبندی
فشار یکی از مفاهیم پایهای در شیمی و فیزیک است که درک آن برای حل مسائل علمی، طراحی فرآیندهای صنعتی و درک پدیدههای طبیعی ضروری است. از واحدهای مختلفی مانند پاسکال، اتمسفر، mmHg و psi استفاده میشود که باید بتوان بین آنها تبدیل انجام داد. کاربردهای فشار در قوانین گازها، تعادل شیمیایی، صنایع شیمیایی و زندگی روزمره بسیار گسترده است. با یادگیری دقیق این مفهوم و تمرین محاسبات مربوط به آن، میتوانید به درک عمیقتری از دنیای اطراف دست یابید.




