مفهوم قطبیت یا پلاریته در شیمی چیست؟
در شیمی، قطبیت (پُلاریته) یکی از مفاهیم اساسی و مهم است که بر خصوصیات و رفتارهای شیمیایی مواد تأثیر میگذارد. قطبیت در واقع به توزیع غیر متقارن بارهای الکتریکی در یک مولکول یا پیوند اشاره دارد. در این مقاله، به طور جامع به مفهوم قطبیت، تأثیر آن بر خواص مواد، نحوه تعیین آن و مثالهایی از مولکولهای قطبی و غیرقطبی پرداختهایم.
قطبیت در پیوندهای شیمیایی
قطبیت یک پیوند به اختلاف الکترونگاتیوی بین اتمهای شرکتکننده در پیوند بستگی دارد. الکترونگاتیوی، قدرت یک اتم برای جذب الکترونهای مشترک در یک پیوند شیمیایی را نشان میدهد. اگر تفاوت الکترونگاتیوی بین دو اتم زیاد باشد، الکترونها به سمت اتم با الکترونگاتیوی بالاتر کشیده میشوند و باعث ایجاد یک بار منفی جزئی در آن اتم و یک بار مثبت جزئی در اتم دیگر میشود. به این نوع پیوند، پیوند قطبی میگویند.
برای مثال، در مولکول HCl (هیدروژن کلرید)، اتم کلر الکترونگاتیوی بیشتری نسبت به اتم هیدروژن دارد، بنابراین الکترونهای مشترک به سمت کلر کشیده میشوند و این باعث میشود مولکول HCl قطبی باشد.
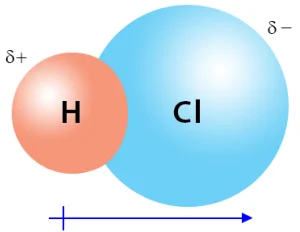
مولکولهای قطبی و غیرقطبی (ناقطبی)
یک مولکول قطبی دارای توزیع نامتقارن بار است. این بدان معناست که یکی از نواحی مولکول دارای چگالی الکترونی بیشتری نسبت به ناحیه دیگر است. برای تشخیص میزان قطبیت یک مولکول، باید ساختار هندسی آن و آرایش فضایی اتمها را در نظر گرفت. در مقابل، مولکولهای غیرقطبی دارای توزیع متقارن بار الکتریکی هستند که منجر به نبود قطبیت در مولکول میشود.
مولکولهای قطبی
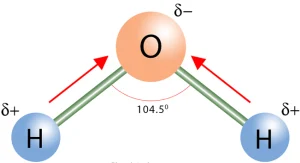
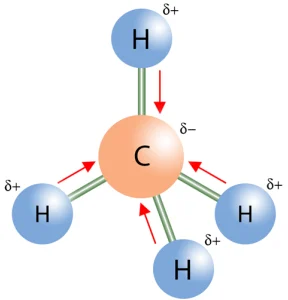
مولکولهایی که حاوی پیوندهای قطبی بوده و ساختار هندسی نامتقارن دارند، مولکولهای قطبی محسوب میشوند. در این مولکولها، ممان دو قطبی خالص (Net Dipole Moment) وجود دارد که نشاندهنده قطبیت کل مولکول است. برای مثال، مولکول آب (H₂O)، با وجود داشتن دو پیوند قطبی O-H، به دلیل شکل خمیده خود، یک مولکول قطبی است.
مولکولهای غیرقطبی
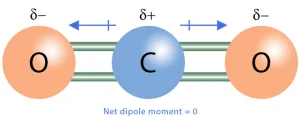
مولکولهایی که یا پیوندهای قطبی ندارند و یا در صورت وجود پیوندهای قطبی، ساختار آنها به گونهای است که ممانهای دوقطبی یکدیگر را خنثی میکنند، مولکولهای غیرقطبی محسوب میشوند. به عنوان مثال، مولکول کربن دیاکسید (CO₂) با وجود دو پیوند قطبی C=O، به دلیل ساختار خطی، یک مولکول غیرقطبی است.
نحوه تشخیص قطبیت یک مولکول
برای تشخیص قطبیت یک مولکول، میتوان مراحل زیر را دنبال کرد:
- تعیین نوع پیوندها: ابتدا باید تعیین کرد که آیا پیوندها قطبی هستند یا خیر. برای این کار، اختلاف الکترونگاتیوی بین اتمها محاسبه میشود. اگر این اختلاف بین 0.4 و 1.7 باشد، پیوند قطبی است.
- بررسی ساختار هندسی مولکول: ساختار مولکول باید با استفاده از نظریه VSEPR یا روشهای دیگر تعیین شود. این نظریه بر اساس نیروی دافعه الکترونها، شکل مولکول را پیشبینی میکند.
- محاسبه ممان دوقطبی: اگر ممان دوقطبی خالصی در مولکول وجود داشته باشد، مولکول قطبی است.
تأثیر قطبیت بر خواص فیزیکی و شیمیایی مواد
قطبیت یک مولکول تأثیر مستقیمی بر خواص فیزیکی و شیمیایی آن دارد. این خواص شامل نقطه جوش، نقطه ذوب، حلالیت و قدرت پیوندهای بین مولکولی میشود.
- نقطه جوش و نقطه ذوب
مولکولهای قطبی به دلیل وجود نیروهای بین مولکولی قویتر، مانند نیروی دوقطبی-دوقطبی و در برخی موارد پیوند هیدروژنی، دارای نقطه جوش و نقطه ذوب بالاتری نسبت به مولکولهای غیرقطبی هستند. به عنوان مثال، آب به دلیل پیوندهای هیدروژنی قوی، دارای نقطه جوش بالاتری نسبت به کربن دیاکسید است.
- محلولیت
قطبیت یک مولکول تعیین میکند که چگونه در یک حلال حل میشود. طبق قانون “شبیه، شبیه را حل میکند“، مولکولهای قطبی در حلالهای قطبی (مانند آب) حل میشوند، در حالی که مولکولهای غیرقطبی در حلالهای غیرقطبی (مانند هگزان) محلول هستند.
- تأثیر قطبیت بر واکنشهای شیمیایی
قطبیت همچنین نقش مهمی در واکنشهای شیمیایی ایفا میکند. مولکولهای قطبی به دلیل توزیع نامتقارن بار، دارای نواحی مثبت و منفی جزئی هستند که میتوانند با مولکولها یا یونهای دیگر واکنش دهند. برای مثال، در واکنشهای اسید-باز، اسیدها با داشتن ناحیهای با چگالی بار مثبت میتوانند با بازهایی که دارای ناحیهای با چگالی بار منفی هستند، واکنش دهند.
نمونههایی از مولکولهای قطبی و غیرقطبی
مولکولهای قطبی
آب (H₂O): شکل هندسی خمیده و وجود پیوندهای قطبی O-H.
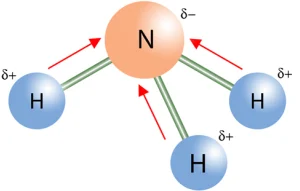
آمونیاک (NH₃): ساختار هرمی و پیوندهای قطبی N-H.
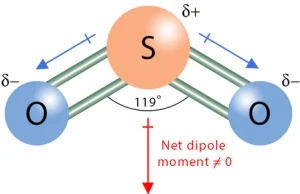
سولفور دیاکسید (SO₂): شکل خمیده و پیوندهای قطبی S-O.
مولکولهای غیرقطبی
متان (CH₄): ساختار چهاروجهی و پیوندهای C-H با قطبیت کم.
کربن دیاکسید (CO₂): ساختار خطی و خنثی شدن ممانهای دوقطبی.
اکسیژن (O₂): پیوندهای همجنس و ساختار ساده.
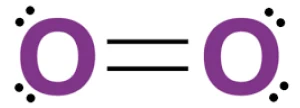
قطبیت و زیستشناسی
قطبیت مولکولها در زیستشناسی نیز نقشی حیاتی دارد. به عنوان مثال، ساختار فسفولیپیدها در غشای سلولی به دلیل ماهیت دوگانه قطبی و غیرقطبی آنها، امکان تشکیل دو لایه لیپیدی را فراهم میکند. این دو لایه باعث ایجاد یک مانع انتخابی میشود که مواد خاصی را از عبور به داخل و خارج سلول منع میکند.
نتیجهگیری
قطبیت یکی از مفاهیم اساسی در شیمی است که بر رفتار و خواص مولکولها تأثیر میگذارد. شناخت دقیق این مفهوم و درک تأثیر آن بر خواص فیزیکی و شیمیایی مواد، به ما کمک میکند تا پیشبینی درستی از نحوه واکنشها و برهمکنشها در مواد مختلف داشته باشیم.



2 پاسخ
مممنون بابت محتوا آیا در پیوند های واحد والس نیز بار جزئی مثبت و جزئی منفی وجود دارد ؟ در چه پیوند هایی وجود دارد؟ توضیحات بیشتری اضافه میکنید پایه دوازدهم.
سلام دوست عزیز. ممنون از توجه شما 🌿
قطبیت یعنی تقسیم نابرابر بار الکتریکی. اگر دو اتمی که پیوند کووالانسی (اشتراکی) تشکیل میدهند، الکترونگاتیویتهی متفاوتی داشته باشند، اتمی که الکترونگاتیوتر است، الکترونها را بیشتر به سمت خود میکشد. در نتیجه، آن سمت بار جزئی منفی (δ⁻) میگیرد و سمت دیگر، بار جزئی مثبت (δ⁺) پیدا میکند. در نتیجه پیوند کووالانسی قطبی (Polar Bond) تشکیل میشود. هر پیوند قطبی داخل مولکول، مثل یک بردار دوقطبی رفتار میکنه که از سمت اتم با بار مثبت جزئی (δ⁺) به سمت اتم با بار منفی جزئی (δ⁻) جهت دارد. وقتی چند پیوند قطبی در یک مولکول داریم، باید بررسی کنیم که آیا بردارهای دوقطبی با هم جمع میشه (مولکول قطبی خواهد بود) یا همدیگر رو خنثی میکنند (مولکول غیرقطبی). پس حتی اگر پیوندها قطبی باشند، ممکن است کل مولکول غیرقطبی (non-polar) شود! همهچیز به تقارن (symmetry) مولکول بستگی دارد. برای اطلاعات بیشتر پیشنهاد میکنم مقاله زیر رو هم مطالعه کنید.
گشتاور دوقطبی (ممان دوقطبی) چیست؟
نیروی واندوالسی، نیروی جاذبه بین مولکولی است.