اوربیتالهای اتمی و آرایش الکترونی
درک ساختار اتم و چگونگی توزیع الکترونها در آن یکی از مفاهیم پایهای در شیمی و فیزیک است. برای درک بهتر این موضوع، ابتدا باید با مفاهیمی چون اوربیتالها و آرایش الکترونی آشنا شویم. این مفاهیم نه تنها در توضیح رفتار اتمها و مولکولها نقش دارند، بلکه در بسیاری از فرآیندهای شیمیایی و فیزیکی نیز کاربرد دارند. در این مقاله به طور مفصل به بررسی اوربیتالها، انواع آنها، و نحوه آرایش الکترونی خواهیم پرداخت.
ساختار اتم
اتمها از هستهای متشکل از پروتونها و نوترونها و الکترونهایی که در اطراف هسته در حرکتاند، تشکیل میشوند. این الکترونها در لایههای مختلفی به نام لایههای الکترونی قرار دارند. این لایهها بر اساس فاصلهشان از هسته، نامگذاری میشوند و میتوانند تعداد محدودی الکترون را در خود جای دهند. این لایهها به نوبه خود به اوربیتالها تقسیم میشوند، که هر یک ویژگیهای خاص خود را دارند.
اوربیتال چیست؟
اوربیتالها نواحی در فضای اطراف هسته اتم هستند که در آنها احتمال یافت شدن یک الکترون به حداکثر میرسد. به عبارت دیگر، این نواحی، مناطقی هستند که احتمال پیدا شدن الکترون در آنها بیشتر از سایر نواحی است. این مناطق به نوعی نقشهای از توزیع الکترونها در اطراف هسته به شمار میآیند. آنها انواع مختلفی دارند که ویژگیهایشان از نظر شکل و انرژی با یکدیگر تفاوت دارند.
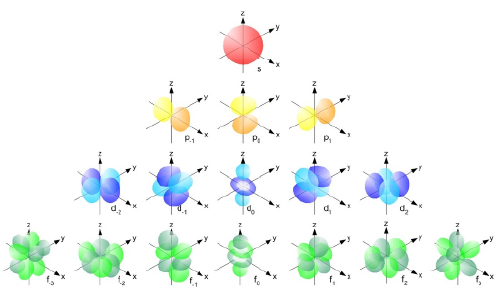
انواع اوربیتالها
نواحی الکترونی (orbitals) بر اساس شکل و ویژگیهای انرژی به چند نوع مختلف تقسیم میشوند:
اوربیتالهای s
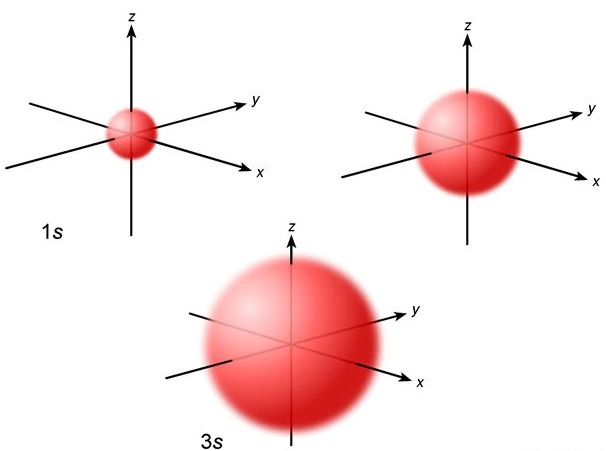
اوربیتالهای s سادهترین نوع هستند. این نواحی الکترونی به شکل کرهای (spherical) هستند و انرژی کمتری نسبت به سایر انواع دارند. هر اوربیتال s میتواند حداکثر ۲ الکترون را در خود جای دهد. اولین لایه انرژی در اتم، تنها یک s دارد که میتواند ۲ الکترون را در خود جای دهد.
اوربیتالهای p
شکل اوربیتالهای p دوناتمانند (گاهاً دمبل مانند هم گفته میشود) است و در سه جهت مختلف در فضای سهبعدی قرار دارند: راستای محور x ،y و z اینها هر کدام میتوانند ۲ الکترون را در خود جای دهند، بنابراین مجموعاً ۶ الکترون میتوانند در سه فضای p موجود در یک لایه انرژی قرار بگیرند. اوربیتالهای p از لایه دوم به بعد در دسترس قرار دارند و برای اتمهایی که از لایه دوم به بالا باشند، مهم هستند.

اوربیتالهای d
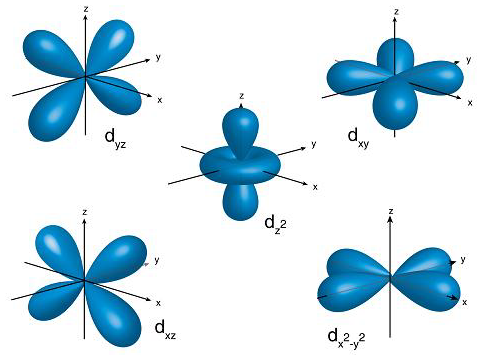
شکل فضایی اوربیتالهای d پیچیدهتر است و در پنج نوع مختلف وجود دارند. هر d میتواند حداکثر ۲ الکترون را در خود جای دهد، بنابراین پنج d میتوانند در مجموع ۱۰ الکترون را در یک لایه انرژی خاص جای دهند. d ها از لایه سوم به بعد بهوجود میآیند و در شیمی مولکولی و پیچیدگیهای ساختار اتمها اهمیت زیادی دارند.
اوربیتالهای f
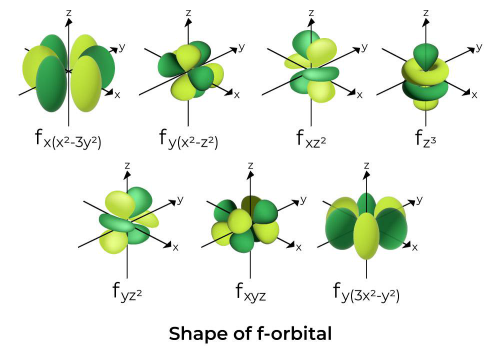
اوربیتالهای f پیچیدهترین نواحی یافت الکترون هستند و بهشکل چندگانهای در فضای سهبعدی توزیع میشوند. f ها از لایه چهارم به بعد ظاهر میشوند و در مجموع ۱۴ الکترون میتوانند در آنها جای بگیرند.
آرایش الکترونی
آرایش الکترونی به توزیع الکترونها در اوربیتالهای مختلف اطراف هسته اتم گفته میشود. این آرایش تعیینکننده خواص شیمیایی و فیزیکی یک عنصر است. برای آرایش الکترونی، چندین قاعده و اصل وجود دارد که باید رعایت شوند.
اصل Aufbau یا اصل ساختار
طبق اصل آفبا Aufbau، الکترونها ابتدا در اوربیتالهایی که انرژی کمتری دارند قرار میگیرند و به تدریج به سطوح با انرژی بیشتر منتقل میشوند. برای مثال، الکترونها ابتدا به s، سپس به p ،d و f وارد میشوند.
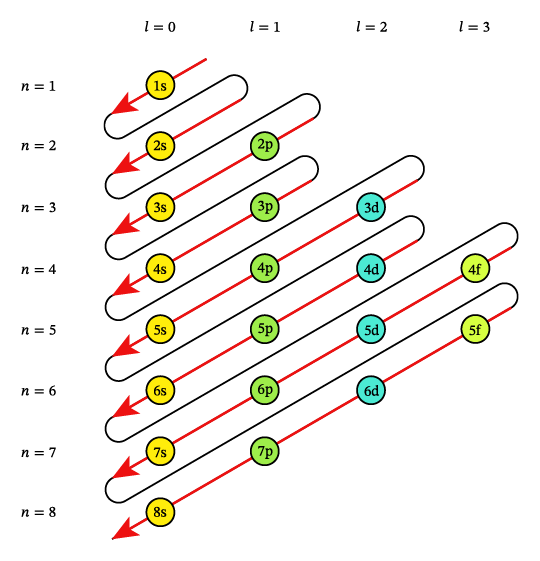
قاعده هوند
طبق قاعده هوند، در یک مجموعه فضاهای همانرژی مثل سه تا p، الکترونها ابتدا به طور تکالکترونی در هر p قرار میگیرند و سپس در صورت نیاز به جفتشدن، دو الکترون در یک اوربیتال قرار میگیرند.
اصل طرد پائولی
اصل پائولی میگوید که هیچ دو الکترون در یک اتم نمیتوانند در تمامی مشخصات (عدد کوانتومی) دقیقا یکسان باشند. به این معنا که در یک ناحیه (orbital)، دو الکترون باید با اسپینهای مخالف (یکی بالا و دیگری پایین) قرار بگیرند.
ترتیب آرایش الکترونی
آرایش الکترونی یک عنصر را میتوان با استفاده از یک نمودار که به نام جدول تناوبی شناخته میشود، ترسیم کرد. برای مثال، آرایش الکترونی اتم کربن (C) به صورت 1s22s22p2 است. این به این معنی است که کربن ۲ الکترون در لایه اول یعنی s، دو الکترون در لایه دوم در s و ۲ الکترون در p لایه دوم دارد.
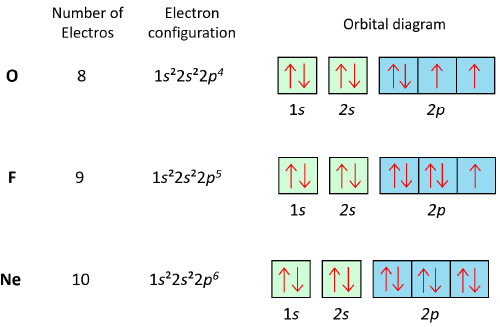
تاثیر آرایش الکترونی بر خواص شیمیایی و فیزیکی
آرایش الکترونی در رفتار شیمیایی اتمها تاثیر زیادی دارد. برای مثال، اتمهایی که در لایه بیرونی خود الکترونهای تکالکترونی دارند، تمایل به ایجاد پیوند با دیگر اتمها دارند. این خصوصیات باعث میشود که هر عنصر ویژگیهای شیمیایی خاص خود را داشته باشد.
گروههای جدول تناوبی و آرایش الکترونی
در جدول تناوبی، عناصر به گروهها و دورهها تقسیم میشوند. گروهها عناصری هستند که دارای آرایش الکترونی مشابه در لایههای بیرونی خود هستند. این ویژگی باعث میشود که عناصر یک گروه خواص شیمیایی مشابهی داشته باشند. برای مثال، گروه ۱ که شامل فلزات قلیایی است، همگی یک الکترون در لایه بیرونی خود دارند و به همین دلیل تمایل زیادی به از دست دادن این الکترون دارند.
لایههای تکمیلشده و پایداری
اگر آرایش الکترونی یک عنصر به گونهای باشد که لایههای الکترونی آن کاملاً پر شده باشند (مثل آرگون یا نئون)، این عنصر بسیار پایدار است و تمایل کمتری به شرکت در واکنشهای شیمیایی دارد. این ویژگی را قانون اکتت (هشت تایی) مینامند که بر اساس آن، اتمها تمایل دارند که لایه بیرونی خود را با ۸ الکترون کامل کنند.
جمعبندی
در این مقاله، ما با مفاهیم نواحی حضور الکترون در فضا (orbitals) و آرایش الکترونی آشنا شدیم و فهمیدیم که چگونه توزیع الکترونها در یک اتم بر خواص شیمیایی و فیزیکی آن تاثیر میگذارد. همچنین، با مفاهیم مهمی مانند اصل آفبا Aufbau، قاعده هوند و اصل طرد پائولی آشنا شدیم که به ترتیب و نحوه قرارگیری الکترونها کمک میکنند. در نهایت، این آرایش الکترونی است که باعث تفاوت در رفتارهای شیمیایی مختلف عناصر میشود و میتوان با استفاده از آن، ویژگیهای شیمیایی و فیزیکی اتمها را پیشبینی کرد.


